El óxido de aluminio o alúmina es un compuesto químico duro usado como abrasivo. Junto al sílice es el principal constituyente de la arcilla. Existe de forma natural en los minerales esmeril y corindón; además, rubíes y zafiros son formas de corindón con impurezas, causantes de los colores característicos de dichas gemas.
Estructura molecular de la alúmina
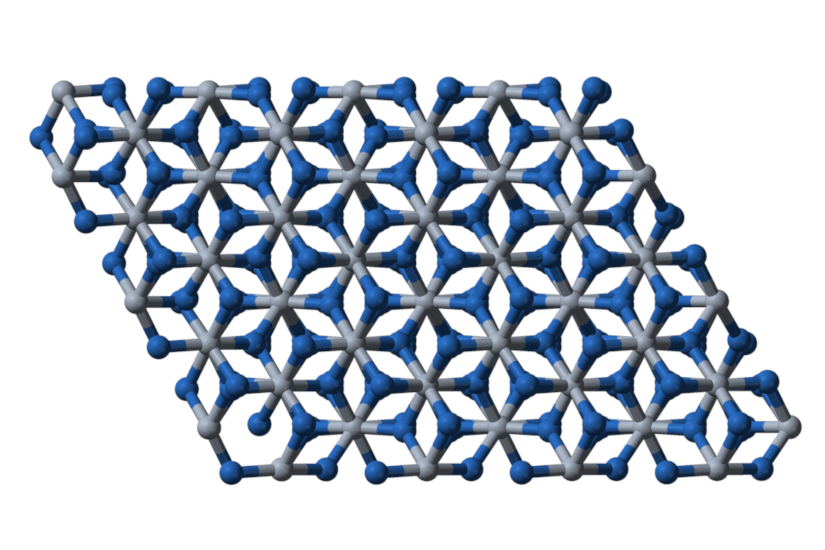
La fórmula molecular de la alúmina es Al2O3. La forma cristalina más común es el corindón, cuya estructura hexagonal compacta se muestra en la Figura 1. Las esferas azul oscuro son los átomos de oxígeno, mientras que las bolas de color más claro representan el aluminio.
Propiedades físicas y químicas del óxido de aluminio
La densidad de la alúmina es de 3961 kg/m³. Sus puntos de fusión y evaporación son de 2072 ºC y 2977 ºC respectivamente. Alcanza un valor de 9 en la escala de dureza Mohs. Su módulo de elasticidad es de 300-400 GPa. Es un aislante eléctrico y no es soluble en agua.
Aplicaciones
El 90 % de la alúmina, cuya producción anual en 2015 fue de 115 millones de toneladas, se emplea para fabricar aluminio. El resto tiene diversas aplicaciones:
- elaboración de cristal
- producción de granos abrasivos para herramientas de corte y desbaste
- material de relleno para plásticos
- aislantes eléctricos para bujías
- ingrediente del protector solar

Producción
El óxido de aluminio se hace con la principal mena del aluminio, esto es, la bauxita. Se suele emplear el proceso Bayer.
En dicho proceso la bauxita se lava, pulveriza y disuelve en sosa cáustica a temperaturas y presiones altas para obtener una solución de aluminato de sodio. Esta se clarifica y precipita en el fondo de un tanque y, acto seguido, se calcina en un horno para retirar el agua y así obtener un polvo blanco: alúmina pura.


 Brocas con refrigeración interna
Brocas con refrigeración interna
 Tijeras cortachapa para cortar perfil de pladur
Tijeras cortachapa para cortar perfil de pladur
 ¿Para qué sirve una llave de cola?
¿Para qué sirve una llave de cola?
 ¿Cómo funciona un cortador de vidrio?
¿Cómo funciona un cortador de vidrio?